
Crédito, Getty Images/BBC
- Author, Chris Baraniuk
- Role, Serviço Mundial da BBC
Sozinho no deserto marciano, um robô buscava respostas. Em 2012, o rover Curiosity da Nasa recolheu uma pequena porção de areia, a ingeriu e a bombardeou com raios X.
O intrépido robô iria descobrir do que aquela areia era feita, que poderia revelar informações sobre a presença histórica de água em Marte — já que toda água naquela planície poeirenta e vermelha havia desaparecido havia muito tempo.
Quase um século antes, em 1915, William e Lawrence Bragg — pai e filho — ganharam o Prêmio Nobel de Física pelo seu trabalho em cristalografia de raios X, uma técnica que permite determinar as estruturas moleculares e atômicas estudando como raios X difratam, ou desviam, ao interagir com eles.
Muitos materiais, de minúsculas proteínas a metais, podem formar cristais, e a cristalografia de raios X tornou-se o padrão-ouro para revelar como várias formas de matéria se formam.
De volta à Terra, Michael Velbel, da Universidade Estadual do Michigan, aguardava ansiosamente pelos dados do Curiosity em Marte. Era a primeira vez que a cristalografia de raios X era realizada em outro planeta.
“Eu acompanhei a missão o tempo todo”, se recorda.

Crédito, Getty Images/BBC
As análises do Curiosity revelaram detalhes do teor de água dos minerais em Marte, o que deu credibilidade — embora não tenha comprovado — à hipótese de que o planeta teve grandes corpos de água há apenas algumas centenas de milhares de anos.
“Finalmente podemos compreender isso”, disse Velbel.
Saber do que as coisas são feitas nos permite fazer coisas incríveis. A análise das estruturas atômicas e moleculares tem ajudado cientistas a desenvolver medicamentos, desvendar os segredos do DNA e até mesmo fabricar baterias melhores.
É possível perceber a importância da cristalografia de raios X porque ela desempenhou um papel em inúmeros Prêmios Nobel — alguns estimam em mais de duas dúzias.
E, ainda assim, poucas pessoas sabem quão incrível essa técnica é.
Padrões regulares
“Muitas pessoas me chamam de ‘Chrystal, a cristalógrafa’ ou C ao quadrado”, brinca Chrystal Starbird, da Universidade da Carolina do Norte.
Ela lembra a primeira vez que usou a cristalografia de raios X para determinar uma estrutura molecular.
“Eu estava olhando para algo que ninguém nunca tinha visto antes. Eu pensei: ‘Uau, que incrível!’.”
Se você já viu um desses modelos de substâncias químicas em formato de bola e vareta, sabe no que os cristalógrafos de raios X trabalham. Eles querem descobrir quais átomos existem em um material e como eles estão ligados entre si.
Quando Starbird realiza esse tipo de análise, um passo inicial fundamental é pegar uma proteína e descobrir como fazer com que ela forme cristais em uma escala muito pequena.
Assim como a água forma cristais de gelo quando congela, as proteínas podem formar minúsculos cristais em determinadas condições.
Esses cristais são então coletados com pequenas alças, semelhantes a fios de cabelo — o que pode ser um procedimento muito complicado —, e colocados em um difratômetro de raios X.
Os cristais são necessários porque, ao incidir raios X sobre a estrutura, obtém-se um padrão de difração regular — marcações precisas específicas para a natureza química do cristal em questão.
No entanto, as proteínas são muito mais complicadas do que as moléculas de água, então, as condições precisam estar extremamente corretas para que elas se cristalizem.
Às vezes, Starbird precisa tentar centenas de abordagens diferentes — usando diferentes substâncias químicas, temperaturas ou níveis de umidade — até que funcione.
“Eu sou alguém que lida bem com a gratificação adiada”, brinca.
Mapeamento de insulina
Uma cientista que provavelmente se identificaria com isso foi Dorothy Hodgkin.
Ela passou 34 anos usando cristalografia de raios X para descobrir a estrutura da insulina, começando na década de 1930.
A insulina é um hormônio que ajuda a controlar os níveis de açúcar no sangue, mas, infelizmente, diabéticos tipo 1 não conseguem produzi-la.
No caso de Hodgkin, obter os cristais de insulina não foi especificamente difícil. Mas, como a insulina contém nada menos que 788 átomos, levou muito tempo para que ela mapeasse toda a estrutura usando os primeiros métodos de cristalografia de raios X.
Sua conquista facilitou muito a produção em massa de insulina para o tratamento de diabetes.
Quando Hodgkin concluiu seus estudos, em 1969, ela já havia ganhado o Prêmio Nobel de Química de 1964 pela sua pesquisa em cristalografia de raios X. Ela também já havia determinado as estruturas da penicilina — um importante antibiótico — e da vitamina B12.

Crédito, Getty Images/BBC
Em um serviço memorial no ano seguinte, Max Perutz — que também recebeu um Prêmio Nobel de Química por trabalhos em cristalografia — disse:
“Suas câmeras de raio X revelaram a beleza intrínseca sob a superfície áspera das coisas.”
Ele elogiou tanto sua bondade quanto “sua força de vontade” para ter sucesso.
“Ela foi uma inspiração incrível”, afirma Elspeth Garman, da Universidade de Oxford, que conheceu Hodgkin.
Garman descreve um padrão de difração de raios X como “uma reflexão incrivelmente complexa”.
Os raios X direcionados a uma estrutura cristalina interagem com os elétrons que orbitam os átomos dentro dessa estrutura e difratam, deixando um traço detectável em uma chapa fotográfica de raios X próxima (na época de Hodgkin).
O resultado é um padrão, que pode ser convertido em um mapa topográfico da estrutura ou em um modelo tridimensional.
Mulheres se destacando
Garman lembra que muitas mulheres se destacaram na cristalografia de raios X. Ela credita isso, em parte, aos Braggs.
“Eles tinham uma árvore acadêmica de mulheres que eles incentivaram e aceitaram como alunas de pós-graduação, enquanto pessoas em outras áreas não faziam isso.”
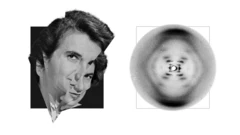
Além de Hodgkin, havia também Rosalind Franklin, cuja imagem de difração de raios X de DNA foi usada por Francis Crick, James Watson e Maurice Wilkins para descobrir a complexa estrutura do DNA, pela qual receberam o Prêmio Nobel de Psicologia ou Medicina em 1962.
Muitos argumentam que Franking nunca recebeu os devidos créditos.
Crédito, Getty Images/BBC
A cristalografia de raios X também esteve envolvida em trabalhos mais recentes que levaram o Prêmio Nobel, incluindo o Prêmio Nobel de Química de 2020 pela tecnologia de edição de genoma, que tem raízes nos estudos cristalográficos de RNA.
Uma aplicação extremamente importante da cristalografia de raios X é na descoberta de medicamentos.
Ela ajudou cientistas a encontrar medicamentos para anemia falciforme e até mesmo para certos tipos de câncer.
Rob van Montfort, líder de grupo no Centro de Descoberta da Medicamentos para o Câncer do Instituto de Pesquisa do Câncer do Reino Unido, diz que a cristalografia pode revelar quais compostos podem bloquear ou controlar proteínas-chaves no corpo e, assim, tratar uma doença.
“A cristalografia de raios X fornece imagens que mostram como, exatamente, o composto se liga à molécula”, explica.
O interior das baterias
Avanços tecnológicos recentes têm permitido estudos de cristalografia cada vez mais complexos, afirma Garman.
Na Diamond Light Source, uma instalação científica no Reino Unido, a equipe usa linhas de feixe de raios X para verificar, em alta velocidade, o potencial medicinal de compostos, analisando possíveis locais de ligação em determinada proteína.
“Em uma única noite, você pode examinar 200. É absolutamente impressionante.”
Pesquisadores também têm usado essa abordagem para estudar materiais de baterias — uma tecnologia fundamental para a transição do uso de combustíveis fósseis.
Phill Charter, líder do grupo de Ciência da Cristalografia da Diamond Light Source, diz que a cristalografia de raios X revela como os materiais dentro das baterias podem se degradar ao longo do tempo.

Crédito, Getty Images/BBC
As baterias de íons de lítio funcionam permitindo que os íons de lítio viajem entre camadas de material — é assim que elas carregam e descarregam energia.
“Manter essa estrutura é muito importante para a vida útil prolongada dessas baterias”, afirma Chater.
Mas a cristalografia permite ver, em alguns casos, como essas camadas estão mudando, afetando a capacidade dos íons de se moverem para dentro e para fora.
Os cientistas podem então buscar maneiras de superar esse problema.
A cristalografia de raios X claramente causou impacto em muitos campos. Mas há um “elefante na sela”, diz Garman.
Uma técnica rival, chamada de crio-microscopia eletrônica (crio-EM), agora permite que os cientistas determinem a estrutura de certas moléculas de uma forma completamente diferente — disparando feixes de elétrons contra elas.
Algumas moléculas eram tradicionalmente pequenas demais para serem vistas por dispositivos de crio-EM. Contudo, soluções estão surgindo.
Há também a inteligência artificial (IA). Se a IA puder prever estruturas moleculares, talvez haja menos necessidade de usar a cristalografia de raios X.
Mas Starbid alerta que há muitas estruturas que a IA não prevê bem.
“Eu acho que as pessoas têm uma ideia errada de que a cristalografia poderá ser substituída em breve, por causa da IA, mas ainda estamos longe disso”, destaca.
Os Braggs, com certeza, ficariam felizes em ouvir isso. E os dispositivos de cristalografia de raios X podem embarcar em aventuras ainda mais emocionantes no futuro.
Velbel sugere enviar um desses dispositivos para um cometa distante orbitando nosso Sol.
“Eu gostaria de ver como é o gelo do cometa”, afirma, explicando que poderíamos encontrar misturas interessantes de compostos incomuns se pudéssemos estudá-los de perto.
“Acho que seria fascinante.”
Esta reportagem foi criada em coprodução entre a instituição Nobel Prize Outreach e a BBC.
Fonte.:BBC NEWS BRASIL












